孟云,董保龙,董晓骅,彭江山,郭辉军,张旭升,杜雪芹,杨晓军,,4,5
(1.甘肃中医药大学第一临床医学院,甘肃 兰州 730000;
2.甘肃省人民医院 普通外科,甘肃 兰州 730000;
3.兰州大学第一临床医学院,甘肃 兰州 730000;
4.甘肃省外科肿瘤分子诊断与精准治疗重点实验室,甘肃 兰州730000;
5. 甘肃省消化道恶性肿瘤防控工程研究中心,甘肃 兰州 730000)
肝细胞癌(hepatocellular carcinoma,HCC)是全球第五大最常见的恶性肿瘤,也是全球癌症病死率的第三大常见原因[1],5年生存率约为7%[2]。在我国目前已经超越胃癌位居我国恶性肿瘤死因的第二位[3]。HCC的发展是一个从慢性炎症,肝硬化,原发性HCC到转移性HCC的多步骤连续过程[4],主要致病因素有慢性乙型和丙型肝炎病毒感染、慢性饮酒和非酒精性脂肪肝[5]。HCC通常在晚期发现,治疗潜力有限,致使高病死率[2,6]。因此,迫切需要开发更有效的预后模型,为HCC的早期预防及临床诊治措施的研发奠定基础,以期降低发病率与病死率。
铜是人体生命活动不可或缺的微量元素[7]。研究[8-10]表明,与健康人相比,癌症患者血清和肿瘤组织中的铜水平显著升高。虽然铜稳态的失调可能触发细胞毒性,但细胞内铜水平的改变可能影响癌症的发生发展[11]。铜离子载体和铜螯合剂已应用于抗癌治疗[12-14]。最近一项研究[15]发现了一种不同于凋亡、坏死、焦亡和铁死亡的铜诱导细胞死亡的方式,并将其称为“铜死亡”。当已知的细胞死亡机制被阻断时,铜离子仍能诱导细胞死亡,在线粒体呼吸过程中,铜离子通过与线粒体三羧酸(tricarboxylic acid,TCA)循环中的脂酰化成分直接结合导致脂酰化蛋白的聚集而发生铜死亡。此外,铜离子还可以降低Fe-S团簇的蛋白质水平。它们都能诱导蛋白质毒性应激反应,并最终导致死亡[15]。
铜在肝脏中的代谢和对肝癌发展的作用目前仍在研究中。张燕军等[16]研究发现,铜含量与肝硬化和HCC密切相关,血清铜和铜蓝蛋白水平可作为检测HCC的标志物。Koizumi等[17]研究表明,氧化还原活性的游离铜水平的升高可能与急性肝炎有关,并最终发展为肝癌。此外,Siddiqui等[18]研究表明,氧化铜纳米颗粒诱导HepG2细胞的细胞毒性和凋亡呈剂量依赖性,这很可能分别是由活性氧和线粒体途径介导的。以上研究表明铜死亡可能与肝恶性肿瘤密切相关,为发现HCC的新治疗方法提供了途径。
本研究探讨HCC中铜死亡相关基因(cuproptosis-related genes,CRGs)的分子改变和临床相关性,为铜死亡调节因子在HCC中的进一步研究奠定了基础。
1.1 数据集来源及预处理
从TCGA(The Cancer Genome Atlas,https://portal.gdc.cancer.gov)数据库中收集HTseq-FPKM格式的424例HCC患者的样本基因表达及相关临床信息,对原始数据进行log2转化得到TPM格式的RNAseq数据。CRGs来源于近期的两项报道[15,19],分别为SLC31A1、PDHB、PDHA1、NLRP3、NFE2L2、MTF1、LIPT1、LIPT2、LIAS、GLS、GCSH、FDX1、DLD、DLST、DBT、DLAT、CDKN2A、ATP7A和ATP7B,结合标准化后基因表达矩阵得到CRGs表达矩阵文件。所有的基因特征(如染色体位置、基因类型、集成id和官方符号)均由基因编码项目(v22)进行注释[20]。临床协变量,包括总生存(overall survival,OS)结局、年龄、性别、肿瘤分期和组织学分级,均来自先前的相关资源[21]。本研究仅纳入有生存信息的HCC患者。
1.2 差异表达分析与突变分析
分析肿瘤和正常样本之间CRGs表达水平的差异,以P<0.05且|log2FC|>2/3为差异表达基因的阈值。为了获得CRGs的突变图,使用cBioPortal数据库(http://www.cbioportal.org)进行基因突变分析。
1.3 CRGs网络富集分析和蛋白质间的相互作用分析
采用“clusterProfiler”包[22]对19个的CRGs进行基因本体(Gene Ontology,GO)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析。GO分析包括生物学过程(biological process,BP)、细胞成分 (cellular component,CC)和分子功能(molecular function,MF)。为了分析这些基因的潜在相互作用,使用GENEMANIA(http://genemania.org)网站[23]进行蛋白质相互作用网络分析。
1.4 预后模型的构建
采用单因素Cox分析筛选预后相关基因,采用“glmnet”包进行Lasso-Cox回归分析得到3个基因用于构建预后评分模型。患者风险评分=∑(每个基因表达水平×相应系数)。根据风险评分的中位数将患者分为高风险组和低风险组。用R包“ggsurvplot”比较高危组和低危组的OS,绘制Kaplan-Meier生存曲线。使用R包“survival ROC”计算受试者工作特征(ROC)曲线分析检验独立风险因素预测生存率的敏感度和特异度,评估模型预测准确性。经过多因素Cox分析,纳入年龄、性别、T分期、N分期、M分期、病理分型、CDKN2A、GLS和DLAT等变量,采用R包“regplot”构建HCC患者列线图,使用R包“rms”进行分析绘制校准曲线。
1.5 与免疫浸润的相关性分析
利用TIMER数据库(cistrome.shinyapps.io/timer)[24]研究CRGs的表达与6种免疫细胞(CD4+T细胞、CD8+T细胞、B细胞、中性粒细胞、树突状细胞和巨噬细胞)丰度以及免疫检查点PDCD1、CD274、HAVCR2之间的关系。
1.6 统计学处理
对TCGA中的HCC患者进行了描述性统计分析。连续变量用均数±标准差(xˉ±s)统计,分类变量用频率和比例统计。采用Kruskal-Wallis秩和检验[25]检测HCC患者在不同分类的病理分期和组织学分级中CRGs表达的差异。所有统计分析均采用R版本4.1.1进行。P<0.05为差异有统计学意义。
2.1 HCC中CRGs的差异表达及基因突变情况
从TCGA下载数据中比较肿瘤和正常组织之间的差异表达基因,结果显示,19个CRGs中,PDHB、PDHA1、MTF1、LIPT1、LIPT2、LIAS、GLS、DLD、DLST、DLAT、CDKN2A和ATP7A在肿瘤组织中高表达;
SLC31A1、GCSH、DBT、NLRP3在肿瘤组织中低表达,差异具有统计学意义(均P<0.05)(图1A-B)。此外,不同基因表达之间的相关性分析发现(图1C),MTF1与ATP7A呈高度正相关(r=0.729,P<0.001)(图1D);
19个CRGs中NLRP2的突变频率最高,为12%(图1E)。
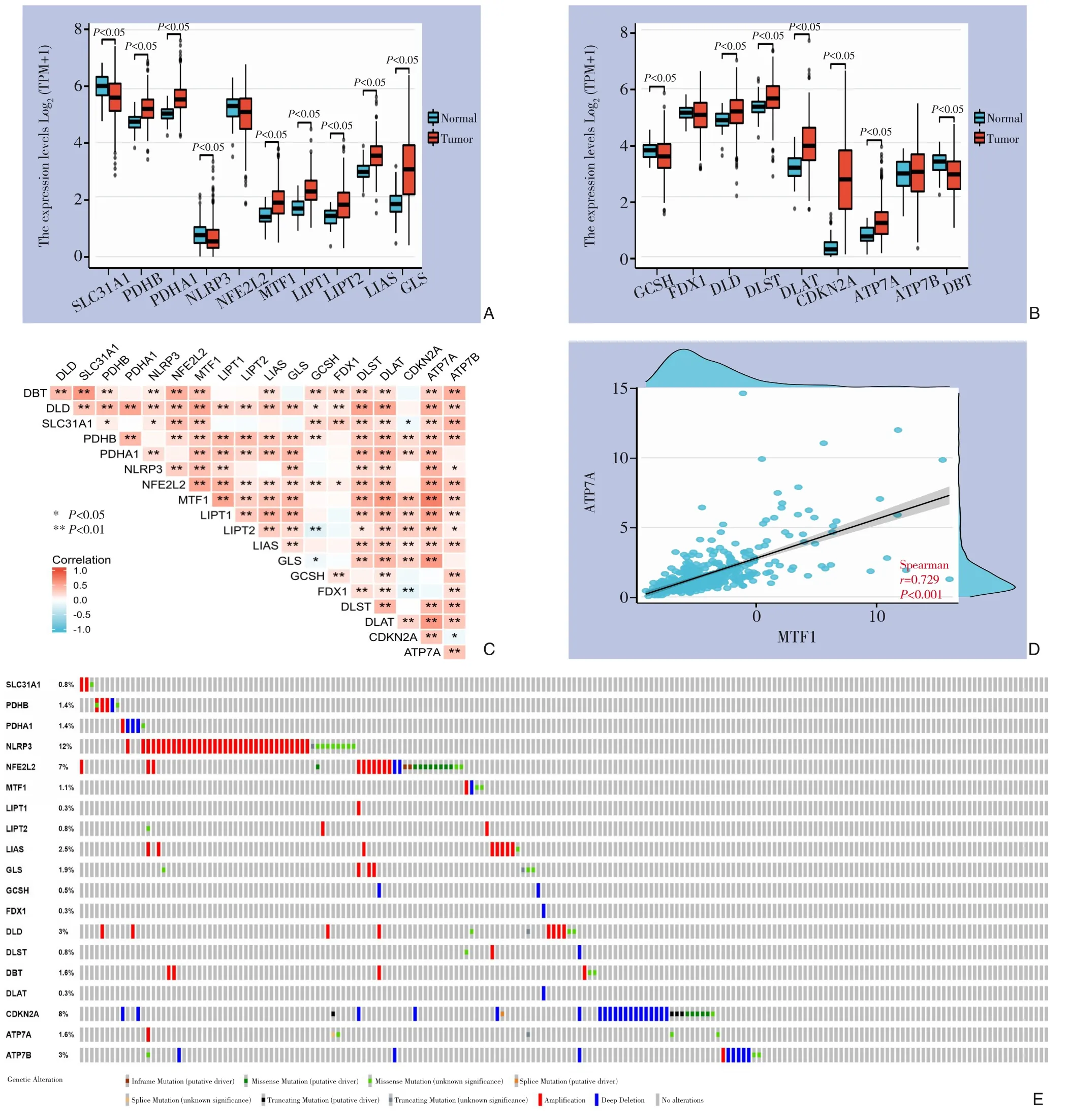
图1 HCC中CRGs的表达和基因改变 A-B:在HCC和正常组织中19个CRGs的表达;
C-D:CRGs表达之间的相关性;
E:HCC中19个CRGs的突变频率Figure 1 Expression and genetic alteration of CRGs in HCC A-B: Expressions of 19 CRGs in HCC and normal tissues; C-D:Correlations between the expression of CRGs; E: Mutation frequencies of 19 CRGs in HCC
2.2 CRGs的功能富集和蛋白-蛋白相互作用(PPI)分析
为验证CRGs的生物学功能,进行GO和KEGG的功能富集分析。参与的BP包括TAC、柠檬酸代谢、乙酰辅酶A的代谢、TCA的代谢过程、丙酮酸对乙酰辅酶A的生物合成;
参与的CC包括线粒体基质、氧化还原酶复合物、二氢脂酰脱氢酶复合物、TAC酶复合物、晚期胞内体;
参与的MF包括具有氧化还原酶活性,作用于供体的醛或氧基,NAD或NADP作为受体、具有转移酶活性的转移酰基、过渡金属离子跨膜转运体活性、除氨基酰基以外具有转移酶活性的酰基。KEGG包括TCA循环、碳代谢作用、丙酮酸代谢、糖酵解/糖异生和铂类药物耐药性。通过PPI分析CRGs的相互作用,结果显示DLD、DLST、DLAT和PDHA1是枢纽基因(图2)(表1)。

表1 CRGs的GO和KEGG的功能富集分析Table 1 Functional enrichment analysis of GO and KEGG for CRGs

图2 TCGA-HCC患者CRGs的GO/KEGG富集和PPI分析 A:CRGs参与的BP;
B:CRGs参与的CC;
C:CRGs发挥的MF;
D:KEGG通路;
E:HCC中CRGs的相互作用蛋白Figure 2 GO/KEGG enrichment and PPI analysis of CRGs in TCGA-HCC patients A: BP associated with CRGs; B: CC associated with CRGs; C: MF played by CRGs; D: KEGG pathway; E: Interacting proteins of CRGs in HCC
2.3 CRGs预后模型的构建
进一步评估HCC中CRGs表达与预后的关系发现,在调整年龄、性别、种族和病理分期后,在单因素Cox比例风险回归模型中,PDHA1(HR=1.467,95%CI=1.036~2.077)、DLST(HR=1.505,95%CI=1.063~2.131)、DLAT(HR=1.689,95%CI=1.191~2.396)、ATP7A(HR=1.432,95%CI=1.013~2.024)、CDKN2A(HR=1.790,95%CI=1.262~2.538)和GLS(HR=1.592,95%CI=1.124~2.255)与OS相关(均P<0.05),其过表达与HCC患者较差的生存率相关,显示出致癌因子的特征(表2)。

表2 CRGs单因素Cox回归分析Table 2 Univariate Cox regression analysis of the CRGs
利用Lasso-Cox回归分析构建了HCC中CRGs关于OS的预后模型。以OS为结局得到3个基因,使用其回归系数构建预后评分:风险评分=0.22×DLAT+0.11×CDKN2A+0.03×GLS(图3)。

图3 TCGA-HCC队列CRGs预后模型构建Figure 3 Prognostic model construction of CRGs in the TCGA-HCC cohort
以风险评分中位数为临界值,将TCGA-HCC队列患者分为高风险组(n=159)和低风险组(n=158)。高风险组患者生存时间较低风险患者生存时间缩短(图4A);
Kaplan-Meier曲线显示,高风险组生存时间缩短(HR=1.90,95%CI=1.34~2.70,P<0.001)(图4B);
ROC曲线评价模型预测性能,曲线下面积(AUC)在1年时达到0.741,3年时达到0.657,5年时达到0.633(图4C)。
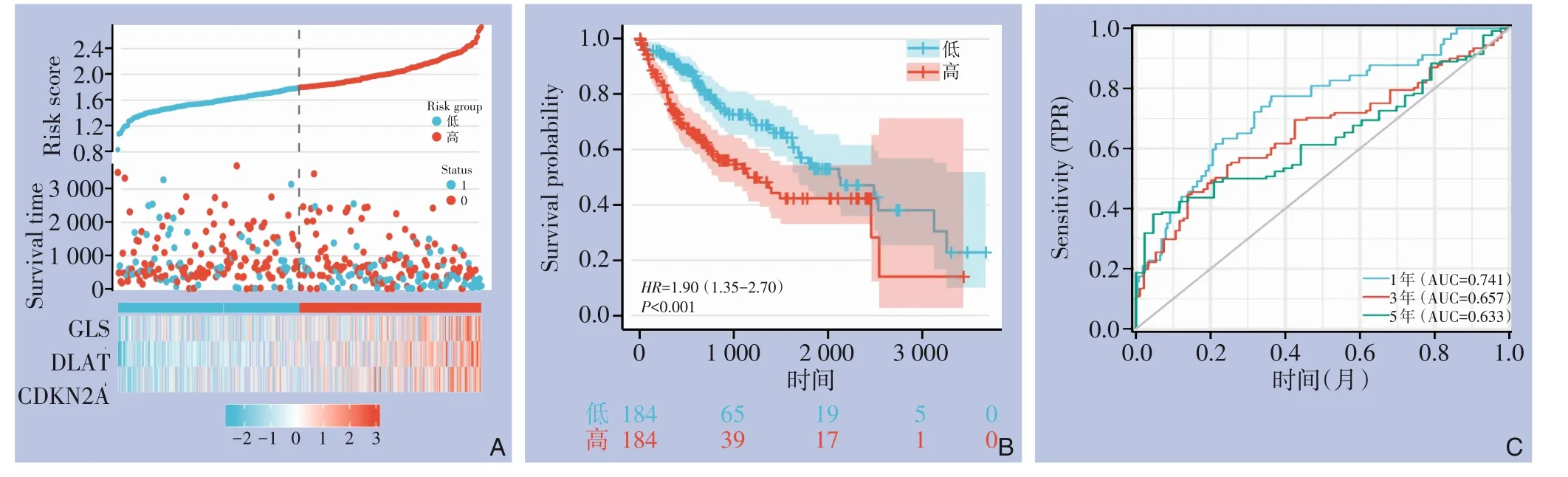
图4 TCGA HCC患者CRGs的临床相关性 A:CRGs风险评分、生存状态和预后的分布;
B:Kaplan-Meier曲线;
C:ROC的1、3、5年生存期预测Figure 4 Clinical relevance of CRGs in TCGA HCC patients A: Distribution of risk score, survival status and prognosis of CRGs; B: Kaplan Meier diagram; C: The 1-, 3- and 5-year survival prediction of ROC
2.4 列线图的开发与验证
为了便于预测模型的临床应用,整合TCGA患者的临床信息和基因特征,采用多变量Cox回归将年龄、性别、T分期、N分期、M分期、病理分型、CDKN2A、GLS和DLAT纳入来建立列线图(图5)。对OS结果采用了鉴别和校准方法(图6A)。OS的C指数为0.696(0.663~0.728),反映了列线图相对较好的预测性能。同时,校准图显示,在生存1、3、5年时,预测的OS与观察到的OS之间具有良好的一致性(图6B)。

图5 铜死亡相关预后生物标志物的单因素和多因素Cox回归分析 A:单因素Cox回归分析;
B:多因素Cox回归分析Figure 5 Univariate and multivariate Cox regression of Cuproptosis-Related prognostic biomarkers A: Univariate Cox regression; B: Multivariate Cox regression

图6 预测HCC患者1、3、5年OS的列线图和校准曲线 A:列线图;
B:列线图预测的校准曲线Figure 6 Nomograms and calibration curves predicting 1-, 3- and 5-year OS of HCC patients A: Nomograms; B: Calibration curves predicted by the nomograms
2.5 HCC中CRGs的表达与免疫浸润水平的相关性
目前尚不清楚CRGs是否会影响肿瘤微环境中的免疫细胞招募,从而影响HCC的预后。因此,本研究分析了GLS、DLAT和CDKN2A与HCC中免疫浸润的关系。GLS、DLAT和CDKN2A的表达水平与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞的免疫浸润水平均呈正相关(均P<0.05)(图7)。结果还显示,HCC中GLS的表达与PDCD1、CD274、HAVCR2的表达水平呈正相关(均P<0.05);
DLAT的表达与CD274和HAVCR2的表达水平相关(均P<0.05);
CDKN2A的表达与PDCD1、CD274和HAVCR2的表达相关(均P<0.05)(图8)。

图7 TIMER数据库中的CRGs表达与免疫浸润的相关性 A:GLS;
B:DLAT;
C:CDKN2AFigure 7 Correlation between the expressions of CRGs and immune infiltration in the TIMER database A: GLS; B: DLAT;C: CDKN2A

图8 HCC患者CRGs表达与免疫检查点(PDCD1、CD274、HAVCR2)表达的相关性 A:GLS;
B:DLAT;
C:CDKN2AFigure 8 Correlations between the expressions of CRGs and the expressions of immune checkpoints (PDCD1, CD274 and HAVCR2) A: GLS; B: DLAT; C: CDKN2A in HCC patients
2.6 HCC在不同病理阶段和组织学分级中CRGs的差异表达
如图9所示,无论肿瘤分期和组织学分级如何,GLS、DLAT和CDKN2A的表达均呈上升趋势。在肿瘤分期中,GLS、DLAT和CDKN2A在I、Ⅲ期的表达水平差异有统计学意义(均P<0.05),CDKN2A在I、Ⅱ、Ⅲ期的表达水平差异均有统计学意义(均P<0.05)(图9A-C)。在组织学分级中,除DLAT在组织学分级中表达水平差异无统计学意义外(P>0.05),GLS、CDKN2A在HCC的组织学分级中的表达水平存在差异(均P<0.05)(图9D-F)。以上结果表明,GLS、DLAT和CDKN2A的表达水平可能与HCC的不良预后密切相关。

图9 GLS、DLAT和CDKN2A在不同病理特征HCC患者中的表达 A-C:不同病理分期;
D-F:不同组织学分级Figure 9 Expressions of GLS, DLAT and CDKN2A in HCC patients with different pathological characteristics A-C:Different Pathological stages; D-F: Different histological grades
铜死亡是最近新发现的一种细胞内游离铜积累,蛋白质脂化导致细胞毒性应激诱导细胞死亡的形式[15]。目前铜死亡在HCC中的相关机制研究较少。HCC患者发现时间较晚,治疗潜力有限,病死率高,使开发稳定的预后指标变得非常重要。本研究基于TCGA数据建立了一个包含3个基因的铜死亡相关评分模型预测HCC预后,高风险评分组HCC患者生存期短于低风险评分组。此外,风险评分是HCC患者独立的预测因子,与临床特征和免疫功能密切相关。
本研究通过对19个CRGs的功能分析,PDHB、PDHA1、MTF1、LIPT1、LIPT2、LIAS、GLS、DLD、DLST、DLAT、CDKN2A和ATP7A等大多数基因在HCC组织中高表达;
LC31A1、GCSH、DBT和NLRP3在HCC组织中低表达,这些结果均未见报道。CDKN2A的表达在细胞周期控制中起作用,并与多种肿瘤的起源密切相关[26-29]。既往研究[30]显示,CDKN2A在子宫内膜癌中表达上调,可能与子宫内膜癌的发病机制有关。尚未有其他研究阐明CRGs在HCC中的表达和功能。相关分析表明,大部分CRGs之间呈正相关。GLS和PDHA1在促进前列腺癌患者更大的谷氨酰胺依赖方面发挥了协同作用[31]。此外,PDHA1、PDHB、DLAT和DLD在丙酮酸脱氢酶复合物缺乏症中发挥了协同作用[32]。GO和KEGG分析显示,CRGs在TCA循环、碳代谢作用、丙酮酸代谢、糖酵解/糖异生和铂类药物耐药性通路中富集,显示CRGs对于HCC的进展,预后以及化疗耐药性等方面具有重要意义。
进一步预后分析显示,GLS、DLAT和CDKN2A水平较高的HCC患者OS较低,表明GLS、DLAT和CDKN2A是HCC潜在的不良预后的生物标志物。有研究[33]表明GLS可以差异地调节人类癌症的预后。另一项研究[34]也表明CDKN2A可作为人类子宫内膜癌的预后生物标志物。Chen等[35]发现LIPT1与尿路上皮癌的生存率相关。越来越多的证据[36]表明,较低水平的PDHA表达与肿瘤细胞的有氧糖酵解和恶性程度显著相关。此外,本研究进行了Lasso-Cox回归分析,建立了一个包括GLS、DLAT和CDKN2A等与预后相关的标志物的生存模型,它们在预测HCC患者的预后方面具有良好的表现。
在免疫浸润分析结果显示,CDKN2A、GLS和DLAT的表达与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞等免疫细胞的丰度呈正相关。有研究[37]报道在HCC中,CDKN2A的表达与CD8+T细胞、CD4+T细胞和中性粒细胞的浸润水平呈正相关,CDKN2A通过影响肿瘤免疫微环境促进HCC进展。另一项整合生物信息学分析[38]显示,CDKN2A与多发性骨髓瘤中的CD4+调节性T细胞、T细胞衰竭和中性粒细胞等免疫信号显著相关。也有研究[39]表明,STAT5和CDKN2A/CDKN2B可促进CD8+T细胞的增殖和终末分化。Colliou等[40]则通过相关研究发现,DLAT基因的表达可显著增加肠道Th17细胞,从而预防相关炎症疾病。
综上所述,本研究结果对于后续铜死亡在HCC的基础研究具有一定的参考价值,可在一定程度上减少实验中的浪费。但研究仍存在一定的局限性:第一,尽管筛选了HCC铜死亡预后基因并建立了预后模型,但没有进一步验证,这是迫切需要在未来进行的研究;
第二,所采用的芯片数据虽然已满足研究所需的样本量,但仍有可能因样本量过少从而导致结果存在一定偏倚;
第三,尽管已经筛选出HCC相关的铜死亡基因,但未能阐明其具体作用机制,这有待后续研究进一步深入挖掘。
利益冲突:所有作者均声明不存在利益冲突。
猜你喜欢基因差异肿瘤相似与差异音乐探索(2022年2期)2022-05-30Frog whisperer疯狂英语·新读写(2021年10期)2021-12-07与肿瘤“和平相处”——带瘤生存中老年保健(2021年4期)2021-08-22修改基因吉凶未卜奥秘(2019年8期)2019-08-28找句子差异小天使·一年级语数英综合(2019年8期)2019-08-27生物为什么会有差异?小学科学(学生版)(2018年7期)2018-08-13创新基因让招行赢在未来商周刊(2017年7期)2017-08-22ceRNA与肿瘤现代检验医学杂志(2016年4期)2016-11-15基因小猕猴智力画刊(2016年6期)2016-05-14床旁无导航穿刺确诊巨大上纵隔肿瘤1例西南国防医药(2015年6期)2015-02-28