胡莎莎,张冬群,张苡芃,韩鹏举,兰利琼,卿人韦
(四川大学生命科学学院生物资源与生态环境教育部重点实验室,成都 610065)
近年来关于基因家族的研究主要集中于转录因子家族、酶家族(激酶、代谢通路相关酶类),如WRKY基因家族、MYB转录因子家族等,关于Actin基因家族的分类、功能分析研究较少.Actin基因家族是一类超基因家族,除了包含典型的Actin蛋白外,还含有ALP同源蛋白结构域,它们具有称为“actin fold”的共同结构特征,这些蛋白由一个多基因家族编码共同组成了Actin 基因家族[1].该基因家族在动植物中广泛存在,与各种微丝结合蛋白共同作用,形成独特的微丝骨架结构,参与成膜体结构的组成、囊泡运输、细胞运动、物质转运、胁迫响应等各项生命活动[2].与动物相比,植物肌动蛋白之间的序列差异更大,表明肌动蛋白基因家族可能在植物中具有更加复杂的生物学功能[3,4].
轮藻植物具有成膜体结构,且微丝、微管等骨架蛋白参与了该结构的组成[5].另外,在轮藻植物中还广泛存在无丝分裂现象,且微丝结构的破坏显著抑制了细胞的无丝分裂过程[6].但目前为止,还未有关于轮藻植物Actin基因家族的鉴定、结构分析等相关研究,因此本研究基于布氏轮藻全基因组对Actin基因家族进行了鉴定分析,从基因序列特征、蛋白理化性质、结构特征、系统发育、启动子顺式作用元件及组织表达等方面对布氏轮藻的Actin基因家族进行系统的研究,以揭示Actin基因家族在轮藻中的基因结构、蛋白特征及可能参与的功能,这一结果也将为进一步探究布氏轮藻的Actin基因家族的具体的生理生化功能及其特殊结构形成的具体分子机制奠定基础.同时,可以为探究轮藻植物无丝分裂现象的基因调控机制提供一定的理论依据.
2.1 材 料
布氏轮藻的基因组文件和注释文件下载于Phyzome基因组数据库(https://phycocosm.jgi.doe.gov/Chabra1/Chabra1.home.html),拟南芥Actin基因家族下载于拟南芥基因组数据库TAIR(https://www.arabidopsis.org/browse/genefamily/index.jsp).
2.2 方 法
2.2.1 成员的鉴定和理化性质分析 利用TBtools根据布氏轮藻基因组文件和注释文件提取基因的CDS序列,并将CDS序列文件转化为蛋白序列文件,去除重复后获得非冗余的蛋白序列文件.基因家族的鉴定通常包括两种方法,第一种方法利用Blast软件通过序列相似性进行序列比对的方法筛选,第二种利用Pfam数据库提供的蛋白结构域模型文件摸索未知序列[7],如果具有相同的结构域则认为该基因属于同一家族成员.为了获得更完整的布氏轮藻Actin基因家族成员,本研究结合了两种方法对布氏轮藻的Actin基因家族进行了鉴定.首先,以拟南芥Actin基因家族蛋白序列作为参考与布氏轮藻的蛋白序列进行本地Blast比对(E-value<10-10), 获得布氏轮藻中Actin基因的潜在序列.在Pfam数据库中下载Actin结构域的隐马尔可夫模型(PF00022),使用HMMER软件对布氏轮藻蛋白序列进行检索(E-value<10-10),筛选包含Actin结构域的潜在基因家族.对blast结果与HMMER结果取并集,将获得的所有蛋白序列提交至NCBI的CD-search网站最终获得包含完整Actin结构域的基因.根据基因在scaffold上的顺序,将其分别重命名为CbACT1~CbACT16.使用ExPASy在线网站获得Actin基因的等电点、分子质量和序列长度等信息,并预测其不稳定系数和平均亲水系数.通过SOPMA网站预测分析蛋白序列的二级结构,并使用Plant-mPLoc进行蛋白亚细胞定位分析.
2.2.2 系统发育及基因结构分析 使用MAFFT软件对获得的蛋白序列进行比对,比对策略选择auto其他参数选择默认[8].将比对结果导入Phylosuite软件[9],使用Trim AI对序列进行修剪,并将其转换为PHY格式,最后通过IQ-TREE进行建树分析, Bootstrap设置为1000[10],IQTREE通过自动检测氨基酸替换模型建立最大似然树.基因结构的展示根据布氏轮藻的GFF注释文件,利用TBtools软件的Gene Structure View程序进行分析.
2.2.3 蛋白保守基序分析和结构域分析 通过MEME在线预测蛋白的保守基序,motif设置为10,其他保持默认选项,利用TBtools软件绘制蛋白保守基序图.利用NCBI的CD-search工具对16条Actin基因进行保守结构域分析,提取结果文件中的结构域信息,将其导入TBtools对蛋白序列的结构域可视化.
2.2.4 染色体定位及共线性分析 使用BLAST对轮藻所有蛋白序列进行双向比对并将双向Blast结果进行合并(E<10-5).利用TBtools结合Excel对GFF文件进行简化处理,将简化的GFF文件及Blast结果文件作为输入文件,通过MCScanX软件进行共线性分析,最后利用TBtools将结果进行可视化[11].
2.2.5 启动子区域顺势作用元件分析 使用TBtools从布氏轮藻的基因组序列文件中提取Actin基因家族成员起始密码子上游2000 bp的DNA序列作为Actin基因的启动子区域,将其提交至PlantCARE网站预测Actin所包含的顺式作用元件.将结果导入到Excel中整理,最后用TBtools软件可视化启动子元件.
2.2.6 转录表达模式分析 根据相关文献下载布氏轮藻基因组数据库中的表达矩阵,检索16个Actin基因在4个不同组织包括营养组织、藏精器、藏卵器及合子中的表达量,将表达量值经过log2(FPKM+1)转换后利用TBtools软件的HeatMap绘制基因表达热图.
3.1 Actin基因家族的鉴定和蛋白理化性质分析
通过序列比对和结构域筛选,共获得布氏轮藻16个Actin基因,根据基因所在Scaffold的排列顺序将所有基因重命名为CbACT1~CbACT16.理化性质分析结果表明Actin基因氨基酸数量在361(CbACT9)~1182(CbACT7)AA之间,分子量在39 886.71(CbACT14)~117 256.72(CbACT13)Da之间,理论等电点在4.68(CbACT12)~8.93(CbACT11)之间,只有三个为碱性蛋白质(理论等电点>7),其余均为酸性蛋白质(理论等电点>7).氨基酸的平均亲水系数表明,除了 2个基因(CbACT1、CbACT15)为疏水性蛋白外(平均亲水系数>0),其余均为亲水性蛋白(平均亲水系数<0).不稳定指数表明有7个蛋白(CbACT2、CbACT5、CbACT7、CbACT11、CbACT13、CbACT15、CbACT116)为不稳定蛋白(不稳定指数>40),其余Actin基因均为稳定蛋白(不稳定指数<40)(表1).

表1 布氏轮藻的肌动蛋白基因家族基本特征
3.2 二级结构预测及亚细胞定位分析
亚细胞定位预测显示除了CbACT13定位于叶绿体之外,其余均定位于细胞质(表2).为了进一步了解Actin基因家族的空间结构特征,对其进行了二级结构分析,结果表明,16条Actin基因均含有α螺旋、无规则卷曲、延伸链和β折叠.其中,α螺旋和无规则卷曲占二级结构总量的26.48%(CbACT2)~46.51%(CbACT2),是该基因家族的主要二级结构元件;
延伸链占比12.30%(CbACT15)~22.22%(CbACT1),β转角所占比例最少,在6.27%(CbACT3)~11.25%(CbACT16)之间.

表2 布氏轮藻的肌动蛋白亚细胞定位及二级结构
3.3 系统发育和基因结构分析
为了研究布氏轮藻的Actin基因家族的系统发育关系和基因结构特征,本研究对布氏轮藻的16条Actin基因的蛋白序列进行了序列比对建树分析和基因结构分析(图1).系统发育分析结果表明布氏轮藻的Actin基因可以分为两个亚家族,结合Actin基因的结构分析,发现同一亚家族的基因

图1 CbACT蛋白进化树及基因结构
结构较为相似,类型I中基因结构较为保守,外显子数目差异较小,基因序列外显子数目均小于4.而类型Ⅱ发生了不同程度的内含子插入导致基因结构变化较大,外显子数目变化范围在1~14之间,这些结构差异的基因进而通过不同的转录加工,参与不同的转录调控过程.
3.4 结构域及保守基序分析
利用NCBI-CDsearch对布氏轮藻的Actin基因进行结构域分析(图2),所有的Actin基因家族均含有Actin的典型结构域,除此之外类型Ⅰ的CbACT7还包含有RT-like结构域,类型Ⅱ有2条序列还包含有F-box-like、PRK-13357的结构域,因此在轮藻中Actin功能还参与了更加复杂的生命活动.为了进一步了解序列的保守特征,利用MEME在线工具对该基因家族的保守基序进行了预测分析,结果显示:motif7,motif3,motif6在所有序列中都存在,属于高度保守序列,可能作为Actin基因家族保守结构域的关键序列而存在.基序在不同家族成员中的分布状态均存在一定的差异,进化关系越相近的成员共有的保守基序越相似,如类型Ⅰ蛋白序列均含有基序1、2、3、4、6、9.因此这些相同的保守基序表明同一亚家族的成员可能具有相似的功能,不同的保守基序可能是不同Actin执行不同功能所必须.
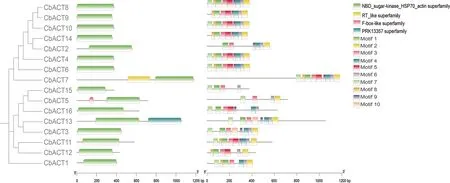
图2 CbACT结构域及保守基序
3.5 染色体定位及共线性分析
Actin基因家族的染色体定位结果表明除了CbACT6、CbACT7、CbACT8分布于同一条scaffold上,其余单独分布于13条scaffold上(图3).为了研究Actin基因家族的扩增机制,利用TBtools对布氏轮藻Actin基因家族进行物种内共线性分析,结果表明只有一对Actin基因为片段复制所产生,没有发现串联重复的基因,推测该植物的Actin基因家族成员少部分是由基因片段复制

图3 CbACT基因染色体定位及共线性分析
产生,大部分成员可能是跟随物种进化遗传而来.另外为了解Actin在不同物种间的进化遗传关系,利用莱茵衣藻、克里藻的全基因组及其Actin基因家族与布氏轮藻的基因组、Actin基因家族进行了物种间的共线性分析,结果并未发现两两之间存在共线性关系.由于目前已解析轮藻纲植物及亲缘关系较近的双星藻纲、鞘毛藻纲基因组较少,因此Actin基因家族在藻类物种间的进化分析缺乏相关的数据支持,未来随着藻类基因组数据库的更加完善将会为不同基因家族在藻类中的进化分析提供一定的帮助.
为了解Actin基因家族可能参与的转录调控过程,本研究分析了16个Actin基因上游2000 bp包含的顺势作用元件.在16个Actin基因家族中共鉴定出1094个顺势作用元件,根据功能将其分为6种类型.所有的Actin基因都包含了大量的基本启动子元件(AT-TATA-box、CAAT-box、TATA-box)和光响应元件(G-box、Sp1、TCCC-motif).其他顺式作用元件主要包括胁迫响应元件包括低温胁迫(LTR)、干旱胁迫(MBS)、厌氧响应(ARE、GC-motif)等;
激素响应元件包括生长素(AuxRR-core)、赤霉素(GARE-motif)、脱落酸(ABRE、)、水杨酸(TCA)、乙烯(ERE)等响应元件.除此之外还有包含了组织特异性元件(CAT-box、RY-element)及与玉米黄素代谢有关的特殊元件(O2-site)(图4和图5).结果表明布氏轮藻的Actin基因广泛参与了轮藻的生长发育、生物和非生物胁迫、激素调控等过程,不同成员之间具有不同数量、种类的启动子元件,从而导致不同成员之间功能的差异性及多样性.

图4 CbACT启动子顺势作用元件

图5 CbACT顺势作用元件统计分析
3.7 不同组织部位表达谱分析
为了解不同Actin基因在轮藻不同组织中的表达情况,本研究基于布氏轮藻RNA-Seq转录组数据,对布氏轮藻不同组织的Actin基因进行了表达量分析(图6).大部分基因的表达量在各组织中表达量较小,CbACT4、CbACT10、CbACT14三个基因的表达量在四个组织中表达量较高,表明这些基因对于调控轮藻植物的生长发育发挥了较大的作用.CbACT5在合子、藏精器、藏卵器三个有性生殖器官中表达量较高,说明该基因可能主要影响了生殖器官的发育过程.另外由片段复制得到的CbACT4和CbACT3具有相似的表达模式,在各组织中表达量相似,表明这两个基因还未发生功能的分化共同调节不同组织的发育过程.
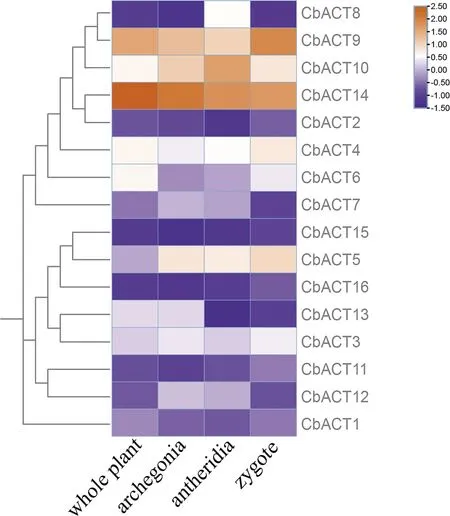
图6 CbACT不同组织表达谱
Actin基因在调节植物形态建成、细胞运动等方面具有重要作用,本研究根据同源性分析和结构域筛选,在布氏轮藻中共获得16个Actin基因,对该基因家族的二级结构分析表明,布氏轮藻的Actin基因家族主要以无规则卷曲为主,与葡萄的Actin二级结构分析结果相似,说明Actin基因家族的结构存在一定的保守性[12];
Actin的亚细胞定位分析结果显示,布氏轮藻的Actin基因除了CbACT13定位于叶绿体,其他15个Actin基因均定位于细胞质,这也与该基因家族主要参与细胞骨架的构成、细胞中物质运输的功能分析结果相一致[13].拟南芥Actin7参与了细胞分裂时叶绿体的移动,因此CbACT13可能也参与了叶绿体相关的生命活动[14].系统发育分析结果显示,轮藻的Actin基因家族可以分为较为结构保守的类型Ⅰ和结构变化较大的类型Ⅱ两个分支.这也与Wu等[15]的研究结果类似,在藻类中Actin基因家族至少可以分为两个分支,其中一个分支序列较为保守,而另外一个分支序列则存在较大的差异.除了典型的Actin结构域之外,布氏轮藻Actin基因还有F-box-like、PRK-13357、RT-like结构域.F-box like蛋白参与调控蛋白降解、信号转导、逆境胁迫等生物学过程[16].RT_like广泛存在于植物基因组中,在一定条件下可以发生转座,从而调控靶向基因的失活、突变等,使得不同基因的表达调控更具有多样性[17].更加复杂的结构域的存在使得轮藻植物的Actin基因家族的功能更加多样化,从而更好地调节植物的环境适应性;
保守基序分析表明,基序3、6、7存在于所有基因家族中,类型I相比与类型Ⅱ共有保守基序更多,这些差异的基序可作为两个亚家族之间分类的依据;
基因复制是基因家族发生扩增的主要方式,布氏轮藻基因组研究结果表明布氏轮藻未发生过全基因组加倍事件,因此基因家族的扩增方式可能主要来自于片段复制[18].但在布氏轮藻中Actin基因家族只有一对基因来自于片段复制,推测可能部分基因在植物逐渐进化过程中由于基因重排、基因转座、基因丢失等原因而导致共线性基因对减少;
基因的表达需要各种转录因子与启动子不同区域结合,从而调控基因适应不同环境的变化,因此启动子顺势作用元件的分析对于了解不同基因的结构、功能分析具有重要意义.对布氏轮藻的启动子顺势作用元件分析结果表明布氏轮藻Actin基因家族启动子区域除了基本启动子元件(CAAT-box、TATA-box、A-box等)外广泛存在光响应(G-box、TCCC-motif、Sp1等)、激素调控(AuxRR-core、ABRE、TGACG-motif等)、生物和非生物胁迫等元件(ARE、LTR、GC-motif等),说明Actin作为植物中重要的基因家族对于布氏轮藻环境适应、生长发育的调控、植物昼夜节律等发挥了重要作用;
轮藻与其他绿藻门植物相比,出现了组织的分化,具有雌雄生殖器官、假根、小枝等,不同基因通过组织特异型表达调控不同组织的分裂分化.通过分析不同组织的表达谱表明,在布氏轮藻中Actin基因家族的功能发生了分化,不同家族成员在不同组织中表达量存在偏好性,有三个基因在不同组织中明显高于其他组织,推测这几个基因相对于其他家族成员对于轮藻的生长发育更为重要.另外,对于来自片段复制的基因对表达谱趋于一致,说明该基因对可能还未发生功能分化,共同参与了植物的生长发育过程.与拟南芥的Actin表达谱相比,在轮藻中Actin并未明显的分为生殖型和营养型两个类型,但有少数几个Actin基因在生殖器官和营养器官的表达出现了较为明显的差异,因此可能在低等的藻类植物中也存在两种类型的基因,但是两种类型的基因在序列相似性上尚未存在明显的差异,所以推测被子植物出现的两种类型的Actin基因是在跟随植物进化过程中由古老的Actin基因逐渐发生变异从而最终分化形成了生殖型和营养型的Actin亚家族.
目前在植物Actin的研究主要集中拟南芥、豌豆、棉花等,但是在其他物种特别是在藻类植物中研究较少.因此Actin基因对轮藻及其他藻类的生长发育、形态建成、胁迫响应等功能的发挥及其内在的分子机制还需要进一步的深入研究.本研究从布氏轮藻全基因组中鉴定16个Actin基因家族,全面分析了Actin基因家族的蛋白理化特性、系统发育关系、基因结构、组织表达模式等,结果表明Actin基因家族广泛参与了轮藻植物的生长发育、胁迫响应等生物学过程,研究结果为Actin基因基因家族在轮藻科中的系统发育研究及对轮藻生长发育的具体功能研究提供了一定的参考价值.
猜你喜欢基序结构域元件细菌四类胞外感觉结构域的概述湖北农业科学(2022年11期)2022-07-18拟南芥START 结构域亚家族生物信息学分析及功能河北农业大学学报(2022年2期)2022-04-26带TRS基序突变的新型冠状病毒威胁更大南方医科大学学报(2022年3期)2022-04-13芥蓝Aux/IAA家族基因生物信息学与表达分析浙江大学学报(农业与生命科学版)(2021年3期)2021-07-10UBR5突变与淋巴瘤B细胞成熟实用肿瘤学杂志(2020年4期)2020-12-08通过合成生物学可改造非豆科植物进行固氮(2020.8.8 iPlants)三农资讯半月报(2020年15期)2020-08-25如何读懂色环电阻中学生数理化·中考版(2016年7期)2016-12-07反渗透膜元件失效的原因分析及对策山东工业技术(2016年15期)2016-12-01宝马i3高电压元件介绍(上)汽车维修与保养(2015年8期)2015-04-17DEP结构域的功能研究进展医学综述(2011年12期)2011-12-09