■河南省鄢陵县第一高级中学 冯存良
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5 K 39 Ca 40 Ba 137 Ce 140
一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.《博物新编》中有关于磺强水制法的记载:“以铅作一密炉,炉底贮以清水,焚硝磺于炉中,使硝磺之气重坠入水,然后将水再行蒸炼,一如蒸酒甑油之法,务使水汽尽行升散,则所存者是磺强水矣。”(提 示:“硝”指KNO3,“磺”指硫黄)下列有关磺强水的说法正确的是( )。
A.“焚硝磺”时发生的是氧化还原反应
B.磺强水是一种易挥发的强电解质
C.0.01 mol·L-1的磺强水溶液的pH=2
D.磺强水溶液中不存在分子
2.有机物a和b的结构简式如下所示,下列有关说法不正确的是( )。

A.a含有四种含氧官能团
B.a能发生取代、加成、氧化等反应
C.a分子中所有碳原子不可能共平面
D.b与 a互为同分异构体
3.下列有关实验操作、现象和所得结论均正确的是( )。

选项 实验操作 现象 结论A 铝箔插入稀硝酸中 无明显现象铝箔表面形成了致密的氧化膜B将足量的H2O2溶液滴入少量的酸性高锰酸钾溶液溶液的紫色褪去 H2O2具 有漂白性C淀粉溶液中加入少量稀硫酸,加热充分反应后,向溶液中加NaOH溶液至溶液呈碱性,再将溶液分成两份一份滴加碘水,溶液不变蓝;另一份加入新制Cu(OH)2悬浊液,加热至沸腾,生成砖红色沉淀淀粉完全水解D取5mL0.1 mol·L-1 KI溶液,滴加5~6滴0.1 mol·L-1 FeCl3溶液,充分反应后,再滴加少量的KSCN溶液溶液变红KI与FeCl3的反应是可逆反应
4.将某Na2CO3固体样品21.6g放入足量水中,固体完全溶解得无色澄清溶液,加CaCl2溶液至过量,得到20g沉淀。已知样品中杂质为KNO3、K2CO3、Ba(NO3)2中的一种或两种。该样品所含杂质的正确判断是( )。
A.肯定有K2CO3,可能有KNO3
B.肯定没有Ba(NO3)2,可能有KNO3
C.肯定有KNO3,可能有K2CO3
D.肯定没有K2CO3和Ba(NO3)2
5.已知X、Y、Z、W是原子序数依次增大的短周期主族元素,位于三个不同的周期。由X、Y、Z组成的某有机物常用于合成高分子化合物,其结构如图1所示。W原子的最外层电子数比Z多。相关说法正确的是( )。

图1
A.该有机物不能使酸性KMnO4溶液褪色
B.Y、Z、W可以组成各原子均满足8电子稳定结构的某种微粒
C.Z的氢化物熔点一定高于Y的氢化物
D.氧化物对应水化物的酸性:W一定比Z强
6.我国科学家开发出一种新型、安全和耐用、低电压和高氢气生产效率的双极制氢系统,其工作原理如图2所示。该电解池内充有4 mol·L-1的KOH溶液,反应涉及的糠醛(用RCHO表示)在有铜催化剂沉积的电极a上转化为相应的羧酸盐和H2,下列说法错误的是( )。

图2
A.电极a上电极反应为2RCHO-2e-+2OH-══2RCOO-+H2↑
B.装置内OH-可穿过离子交换膜移向a电极
C.电解池b电极区pH将升高
D.电路中转移1 mol电子,可产生标准状况下22.4 L H2
7.某元素M的氢氧化物M(OH)2(s)在水中的溶解反应为M(OH)2(s)M2+(aq)+2OH-(aq),M(OH)2(s)+2OH-M(OH(aq),25 ℃,-lgc与pH的关系如图3所示,c为M2+或M(浓度的值。下列说法错误的是( )。
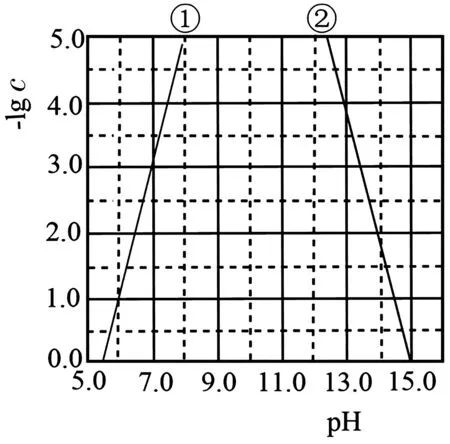
图3
A.曲线①代表-lgc (M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-17
C.向c(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)存在
二、非选择题(共58分,第8~10题为必考题,每个试题考生都必须作答。第11~12题为选考题,考生根据要求作答)
(一)必考题(共43分)
8.(14分)碲(Te)元素是当今新材料的主要成分之一。工业上从电解法精炼铜的阳极泥中提取纯度较高的碲,经预处理后的阳极泥中含TeO2及铁、铅、铜的化合物等,通过以下流程制备高纯碲:

已知:①TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。
②部分难溶物的Ksp如表1所示:

表1
回答下列问题:
(1)“碱浸”时TeO2发生反应的化学方程式为_____。
(2)加入Na2S溶液的主要目的是____。
(3)“沉碲”发生反应的化学方程式为_____。
(4)“酸溶”后,将SO2通入溶液中进行“还原”得到粗碲,该反应的化学方程式是_____。
(5)电解法提纯粗碲时,以Na2TeO3溶液为电解质溶液,阳极材料为____。电解过程中阴极的电极反应式为____。
(6)常温下,向0.1 mol·L-1Na2TeO3溶液中滴加盐酸,当溶液pH=5时,溶液中c()∶c(H2TeO3)=____。(已 知:H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)
9.(14分)氰化钠(NaCN)是一种重要的基本化工原料,用于化学合成、电镀、冶金和有机合成医药、农药,同时也是一种剧毒物质,一旦泄漏需要及时处理。一般可以用二氧化氯(ClO2)水溶液或硫代硫酸钠(Na2S2O3)溶液来处理,以减轻环境污染。回答下列问题:
Ⅰ.(1)NaCN用二氧化氯(ClO2)水溶液处理后,CN-被氧化为CO2和N2,该反应的离子方程式为_____。
Ⅱ.工业制备硫代硫酸钠的反应原理:2Na2S+Na2CO3+4SO2══3Na2S2O3+CO2。某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。
【实验一】实验室通过如图4所示装置制备硫代硫酸钠。

图4
关闭K1,打开K2,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。
(2)①装置C中盛放Na2S和Na2CO3混合溶液的仪器名称是_____。
②装置B的作用是_____。
③实验结束后装置D烧杯中的溶质除NaOH外,还可能有____。
(3)实验结束后,在E处可连接盛有____(填标号)的注射器,再关闭K2,打开K1,以防止拆除装置时装置中的有害气体逸出污染空气。
A.BaCl2溶液 B.浓硫酸
C.酸性KMnO4溶液 D.NaOH溶液
【实验二】测定硫代硫酸钠产品纯度并处理废水中的氰化钠。
制备的硫代硫酸钠产品一般为Na2S2O3·5H2O,一般可用I2的标准溶液测定产品纯度:取10g产品配制成250 mL溶液,取25 mL溶液,用浓度为0.100 0 mol·L-1I2的标准溶液进行滴定(原理为2Na2S2O3+I2══Na2S4O6+2NaI),相关数据记录如表2所示:

表2
(4)①上述滴定操作中应该选用_____作为反应的指示剂。
②Na2S2O3·5H2O产品的纯度为____。
(5)查阅资料知氰化钠与硫代硫酸钠的反应是NaCN+Na2S2O3══NaSCN+Na2SO3;实验室中NaSCN可以代替KSCN检验_____(填离子符号)。
10.(15分)丙烯是一种重要的有机化工原料,丙烷脱氢是丙烯工业生产的重要途径。其反应为C3H8(gH6(g)+H2(g)ΔH1=+123.8 kJ·mol-1,副反应主要是C3H8(g)+H2(g)CH4(g)+C2H6(g)ΔH2。回答下列问题:
(1)已知:①C3H8(g)CH4(g)+C2H4(g) ΔH3=+81.7 kJ·mol-1
②C2H4(g)+H2(g)C2H6(g)ΔH4=-136.5 kJ·mol-1
则ΔH2=____kJ·mol-1,从温度和压强的角度考虑,丙烷脱氢适宜条件为_____。
(2)丙烷在ZnOx催化剂表面脱氢机理如图5所示:

图5
已知一个电子的电量为1.6×10-19C,该反应过程中决速步骤反应的热化学方程式为_____。
(3)进料氢烃物质的量之比为0.5,在不同压力下,丙烷脱氢反应的平衡转化率随温度的变化如图6所示。

图6
①a、b、c三点对应主反应的平衡常数Ka、Kb、Kc的相对大小关系为____。
②已知a点对应C3H8的平衡转化率为α,丙烯选择性为ω(ω =),则该温度下主反应对应的平衡常数Kp=____MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,写出计算式)。
(4)丙烷氧化脱氢是一种新型制备丙烯的方法:2C3H8(g)+O2(g)══2C3H6(g)+2H2O(l) ΔH=-101.6 kJ·mol-1。但此方法通常产生CO2较多,丙烯产率较低,原因是____。使用一种复合催化剂Pt/Al2O3-In2O3如图7,将丙烷脱氢生产丙烯和氢气燃烧反应进行选择性偶联(实现分步连续性反应),可大幅提高丙烷转化率。其原因是____。

图7
(5)质子导体固体氧化物燃料电池生产烯烃的原理如图8所示:

图8
①B电极是____(填“正极”或“负极”),该电极的电极反应式为____。
②若装置中只生成丙烯一种烯烃,当电路中有2 mol电子转移时,通过离子交换膜的离子为_____mol。
(二)选考题(共15分。请考生从2道题中任选一题作答。如果多做,则按所做的第一题计分)
11.[选修3:物质结构与性质](15分)
稀土元素是指钪(Sc)、钇(Y) 和镧系元素,共17种,位于元素周期表中第ⅢB族,均为金属元素,在工业生产中有重要的作用。回答下列问题:
(1)基态钪(Sc)元素的原子核外电子占据的轨道数目共_____个,钇(Y)位于元素周期表中钪(Sc)的下一周期,钇(Y)的外围电子排布式为_____。
(2)稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,其中有一个能提供孤电子对的原子为一齿(羰基中的氧原子不能提供孤对电子),EDTA____齿配位体,它的配位原子为____,其中C原子的杂化方式为____。
(3)钪(Sc)离子在水中以稳定的[Sc(H2O)6]3+存在,其空间构型为_____。
(4)铈(Ce)属于镧系元素,氧化铈是一种重要的光催化材料。
①铈具有三价和四价两种价态,三价和四价间的可逆转换会造成氧空位的生成和消除。其光催化的基本原理如图9所示,当光照能量(hν)等于或大于氧化铈催化剂的Eg时,氧化铈VB上的电子(e-)会受到激发跃迁至CB,留下带正电荷的空穴(h+),形成光生电子-空穴对,与所吸附的物质发生氧化还原反应。则在氧化还原反应中,空穴可视为____(填“氧化剂”或“还原剂”),图中A发生_____(填“氧化”或“还原”)反应。

图9
②氧化铈的晶体结构如图10所示,其中铈原子和氧原子的数量之比为____,若晶体密度为dg·cm-3,阿伏加德罗常数为NA,晶胞参数a=____cm。

图10
12.[选修5:有机化学基础](15分)
中国工程院院士、国家卫健委专家组成员李兰娟团队初步测试,在体外细胞实验中显示:阿比朵尔在10~30μmol浓度下,与药物未处理的对照组比较,能有效抑制新冠病毒达到60倍。阿比朵尔的合成路线如下:

回答下列问题:
(1)E的分子式为_____,D的结构简式为_____。
(3)反应④的试剂a是____。
(4)由C到F的过程中,设计反应③的目的是____。
(5)反应⑥在乙酸介质中进行,写出其化学方程式:____。
(6)H是B的同分异构体,满足下列条件的H的结构有____种(不考虑立体异构)。
A.分子结构中含有五元环
B.分子结构中含有氨基(—NH2)
C.能与碳酸氢钠溶液反应产生气体
写出符合上述条件且核磁共振氢谱有五组峰的结构简式:___(只需写一种)。
猜你喜欢硫代硫酸钠丙烷丙烯《共生》主题系列作品大众文艺(2022年16期)2022-09-07硫代硫酸钠置换滴定法测定高铁酸盐的纯度理化检验-化学分册(2020年5期)2020-06-15硫代硫酸钠配置时的析硫现象对磷生铁测磷含量的影响中国金属通报(2019年7期)2019-08-13苯丙烯菌酮农药科学与管理(2019年5期)2019-08-13——硫代硫酸钠">高考热点——硫代硫酸钠数理化解题研究(2019年7期)2019-03-27流化床丙烷脱氢反应段的模拟及优化石油石化绿色低碳(2019年6期)2019-01-14丙烷制冷压缩功耗分析山东化工(2018年10期)2018-06-07气相色谱-质谱联用法检测血液中的1,2-二氯丙烷灾害医学与救援(电子版)(2018年1期)2018-06-05液化气中的丙烯含有的杂质对丙烯聚合反应的影响当代化工研究(2016年7期)2016-03-20催化裂化多产丙烯化工进展(2015年6期)2015-11-13